|
Die
Salpetergewinnung vergangener Zeiten: |
|
Anfänglich
wurde Salpeter aus Italien (Sizilien) via Venedig importiert, als sich aber
die Qualität verschlechterte und die Preise stiegen, ging man dazu
über, den Salpeter aus der Erde zu laugen. Mit der
Viehzucht fallen in jeder Hochkultur große Mengen an Tierfäkalien
an. Diese wurden und werden immer noch in Mistgruben entsorgt und gegen
Geruch meist mit Asche bedeckt. Aus dem bakteriellen Abbau der organischen
Stickstoffverbindungen der Fäkalien entstehen die Nitrate. Das
Kaliumkarbonat der Holzasche ergibt mit dem aus der Gülle gebildetem
Nitrat den Salpeter, das Kaliumnitrat. Dies unterscheidet sich von den
ursprünglich im Mist gebildeten Nitraten durch seine
Wasserlöslichkeit: Kaliumnitrat löst sich in heißem Wasser
viel besser als in kaltem, bei 100°C lösen sich in 100g Wasser ca 250g Kaliumnitrat, kaltes Wasser dagegen löst nur
40g pro 100ml. Dieses
Phänomen führte dazu, daß sich in
gemauerten Mistgruben am Tag viel Salpeter auflöste und mit als Lösung
die Wände hinaufdiffundieren konnte. Bei
fallenden Temperaturen kristallisierte dann eine dünne Schicht Salpeter
an den Wänden der Dunggruben aus. Durch ständige Wiederholung des
Vorgangs konnten sich so erhebliche Mengen Salpeter abscheiden. Beim Auflösen
Kristalle in Wasser wurde dann zwangsläufig die
Temperaturabhängigkeit der Löslichkeit beobachtet und zur Reinigung
des Salpeters verwendet.Es ist nicht zu
klären, wo die brandfördernden Eigenschaften des Salpeters zuerst
beobachtet wurden, da mit der Seßhaftigkeit
und Viehzucht praktisch überall Salpeter potentiell verfügbar war.
Diese Entdeckung könnte also auch in Gegenden gemacht worden sein, in
denen kein gediegener Salpeter zur Verfügung stand.
Im 17Jh waren
die Übergriffe der Salpeterstecher insbesondere in England sehr
gefürchtet, da sie das königliche Recht hatten, überall nach
Belieben nach Salpeter zu graben. |
|
Dieser Schritt
ist also als eigentlicher Syntheseschritt aufzufassen.
Nach und nach
wurden die größeren natürlichen Vorkommen systematisch
abgebaut. Der intensivste Abbau fand in den großen natürlichen
Vorkommen in Chile statt, besonders im 19.Jh zur Herstellung von Kalisalpeter
und Düngemitteln. Mitte des 19.Jh
stieg die Nachfrage nach Salpetersäure zur Nitrierung von Baumwolle,
Glycerin und Phenol zur Sprengstoffherstellung rapide an. Derselbe Sprung
fand Anfang des 20.Jh statt. Die natürlichen Reserven reichten bald
nicht mehr aus zur Deckung der Nachfrage, was mit rapidem Preisanstieg
einherging. Der weite und teure Schiffstransport des Rohstoffs und die
zeitweise mangelnde Verfügbarkeit auf dem Europäischen Festland
führte erst Anfang des 20.Jh zur Entwicklung eines technischen
Verfahrens zur Salpeterherstellung. |
|
|
||
|
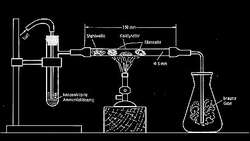
Grundlage der
heutigen Herstellung ist diese Ammoniakverbrennung, die Umsetzung von
Ammoniak mit Luft zu Stickstoffoxiden. Diese bilden mit Wasser
Salpetersäure und Salpeterige Säure, wovon erstere dann mit
Kalilauge (praktisch überall frei verfügbar) zum Kaliumnitrat
umgesetzt wird. Andere Salpetersorten wie Strontiumnitrat, Bariumnitrat,
Natriumnitrat, Ammoniumnitrat werden analog
hergestellt. Dieses Verfahren wurde vom deutschen Chemiker Wilhelm Ostwald
erfunden und ist nach ihm benannt. Der Katalysator
ist in neueren Methoden ein sehr dünnes Platinnetz, durch das mit hoher
Geschwindigkeit die Ammoniak-Luft Mischung gepresst wird. Das Problem hierbei
ist die notwendige, rasche Abkühlung der Reaktionsgase, da unter den
Bedingungen der Reaktion das gebildete Stickstoffoxid wieder zu Stickstoff
und Sauerstoff zerfällt. Das
gewünschte Nitrat wird nun nach folgenden Reaktionen gebildet:
so dass man schliesslich zur Salpetersäure kommt, welche mit
Kalken zu den pyrotechnisch wichtigen Nitraten umgesetzt wird. Im wesentlichen läuft der Prozess also exakt analog zu
den Vorgängen in der Natur, in denen Bakterien die stickstoffhaltigen
organischen Verbindungen zum Nitrat oxidieren, um die freiwerdende Energie
(in diesem Fall ca 330kJ / mol NH3!!!)
und die Protonen der Salpetersäure zum Lebensunterhalt zu gebrauchen. |
|
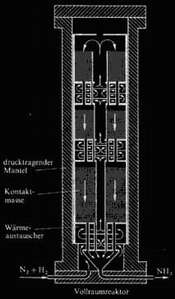
Das Haber-Bosch
Verfahren setzt Wasser- und Stickstoff bei 500°C und 200bar zu einem
Umsatz von 11% um, der Ammoniak wird abgetrennt und das Restgas ohne
Dekompression im Kreislauf zurückgeführt. Die exotherme
Reaktion setzt genug Energie frei, um das Verfahren ohne äußere
Heizung durchzuführen. Der Katalysator
besteht nicht mehr im ursprünglich verwendetem
Osmium, sondern aus promotiertem Eisenoxid, das mit
geringen Mengen Aluminium-, Kalium und Calciumoxid dotiert ist. Erst mit der Ammoniaksynthese aus den Elementen
waren Dünge- und Sprengmittel in unbegrenzter Menge verfügbar. |
|
|
|
|